|

ปฏิกิริยาเคมีโดยทั่วไป
อัตราการเกิดปฏิกิริยาเคมีมักขึ้นอยู่กับความเข้มข้นของสารตั้งต้นที่เข้าทำปฏิกิริยา
ซึ่งสามารถอธิบายโดยใช้ทฤษฤีการชนกันว่า
เมื่อเพิ่มความเข้มข้นของสารตั้งต้น
จำนวนอนุภาคของสารตั้งต้นที่เข้าทำปฏิกิริยาก็มีมากขึ้นด้วย
จึงทำให้อนุภาคของสารตั้งต้นมีโอกาสชนกันมากขึ้น
และเมื่ออนุภาคที่เข้าชนกันมีพลังงานมากพอ
ก็สามารถเกิดปฏิกิริยาขึ้นได้ แต่ถ้าความเข้มข้นของสารตั้งต้นลดลง
อัตราการเกิดปฏิกิริยาก็จะลดลง ดังรูป
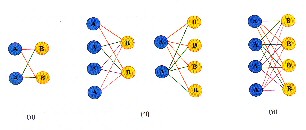
รูปแสดงผลของความเข้มข้นต่อจำนวนการชนก้นของอนุภาค
(ก)
โมเลกุล A กับโมเลกุล B ชนกันได้
4 แบบ
(ข)
เมื่อเพิ่มความเข้มข้นของ A หรือ
B เป็น 2 เท่า โมเลกุลจะชนกันได้
8 แบบ
(ค)
เมื่อเพิ่มความเข้มข้นของทั้ง A
และ B เป็น 2 เท่า โมเลกุลจะชนกันได้
16 แบบ
 ในปฏิกิริยาที่สารตั้งต้นมีสถานะเป็นก๊าช
สามารถพิ่มอัตราการเกิดปฏิกิริยาได้ โดยการเพิ่มความดันของระบบ
เนื่องจากเมื่อความดันของระบบสูงขึ้น
ก็เป็นการเพิ่มความเข้มข้นของสารตั้งต้น
จึงทำอนุภาคมีโอกาสชนกันมากขึ้น ในปฏิกิริยาที่สารตั้งต้นมีสถานะเป็นก๊าช
สามารถพิ่มอัตราการเกิดปฏิกิริยาได้ โดยการเพิ่มความดันของระบบ
เนื่องจากเมื่อความดันของระบบสูงขึ้น
ก็เป็นการเพิ่มความเข้มข้นของสารตั้งต้น
จึงทำอนุภาคมีโอกาสชนกันมากขึ้น
 ปฏิกิริยาที่มีสารตั้งต้นมากกว่าหนึ่งชนิด
อัตราการเกิดปฏิกิริยาอาจขึ้นอยู่กับความเข้มข้นของสารตั้งต้นทุกชนิดหรือชนิดใดชนิดหนึ่ง
หรือปฏิกิริยาบางชนิดอัตราการเกิดปฏิกิริยาไม่ขึ้นอยู่กับความเข้มข้นของสารชนิดใดเลย
นั่นคือไม่ว่าสารตั้งต้นมากน้อยเพียงใด
ก็จะไม่มีผลกระทบต่ออัตราการเกิดปฏิกิริยาเคมี
เข่น ปฏิกิริยาที่มีสารตั้งต้นมากกว่าหนึ่งชนิด
อัตราการเกิดปฏิกิริยาอาจขึ้นอยู่กับความเข้มข้นของสารตั้งต้นทุกชนิดหรือชนิดใดชนิดหนึ่ง
หรือปฏิกิริยาบางชนิดอัตราการเกิดปฏิกิริยาไม่ขึ้นอยู่กับความเข้มข้นของสารชนิดใดเลย
นั่นคือไม่ว่าสารตั้งต้นมากน้อยเพียงใด
ก็จะไม่มีผลกระทบต่ออัตราการเกิดปฏิกิริยาเคมี
เข่น
 ปฏิกิริยาการกำจัดแอลกอฮอล์ออกจากกระแสเลือดในตับ
โดยปกติเมื่อมีแอลกอฮอล์เข้าสู่กระแสเลือก
ร่างกายจะต้องกำจ้ดออกทั้งในรูปแอลกอฮอล์โดยตรงและการสลายเป็นสารอื่น
อัตราการสลายตัวของแอลกอฮอล์เป็นสารอื่นจะมีค่าคงที่
โดยไม่ขึ้นอยู่กับปริมาณของแอลกออล์ในเลือดว่ามีอยู่มากน้อยเพียงใด ปฏิกิริยาการกำจัดแอลกอฮอล์ออกจากกระแสเลือดในตับ
โดยปกติเมื่อมีแอลกอฮอล์เข้าสู่กระแสเลือก
ร่างกายจะต้องกำจ้ดออกทั้งในรูปแอลกอฮอล์โดยตรงและการสลายเป็นสารอื่น
อัตราการสลายตัวของแอลกอฮอล์เป็นสารอื่นจะมีค่าคงที่
โดยไม่ขึ้นอยู่กับปริมาณของแอลกออล์ในเลือดว่ามีอยู่มากน้อยเพียงใด

|

