|

ปฏิกิริยาเคมีส่วนมากโมเลกุลของสารตั้งต้นไม่ได้ชนกันเพียงครั้งเดียวก็จะเกิดปฏิกิริยาได้เป็นสารผลิตภัณฑ์
แต่มักมีการชนกันของโมเลกุลหลายครั้งจึงสามารถเกิดเป็นผลิตภัณฑ์ได้
ปฏิกิริยานี้จึงต้องเกิดหลายขั้นตอนอย่างต่อเนื่องเป็นลำดับ
เรียกว่า กลไกของปฏิกิริยา (
Reaction Mechanism) และในระหว่างที่ปฏิกิริยาดำเนินไปแต่ละขั้น
จะเกิดสารที่ไม่เสถียร และไม่ใช่สารผลิตภัณฑ์
เรียกว่าอินเทอร์มีเดียต (
Intermediate)
 ตัวอย่าง
ปฏิกิริยาที่มีกลไกการเกิดหลายขั้นตอน
เช่น ปฏิกิริยาระหว่างก๊าชไฮโดรเจน
กับโบรมีน ดังสมการ า ตัวอย่าง
ปฏิกิริยาที่มีกลไกการเกิดหลายขั้นตอน
เช่น ปฏิกิริยาระหว่างก๊าชไฮโดรเจน
กับโบรมีน ดังสมการ า
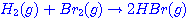
มีกลไกในการเกิดปฏิกิริยา
3 ขั้นตอน ดังนี้
ขั้นตอนที่ 1  (เร็ว) (เร็ว)
ขั้นตอนที่
2  (ช้า) (ช้า)
ขั้นตอนที่
3 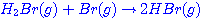 (ช้า (ช้า


กราฟแสดงพลังงานในการเกิดปฏิกิริยาที่มีกลไกการเกิดปฏิกิริยาหลายขั้นตอน
จากกราฟ ในการพิจารณาว่าปฏิกิยาเป็นคายพลังงานหรือดูดพลังงานหาได้จาก

จากกราฟ
จะเห็นว่าปฏิกิริยามีหลายขั้นตอน จึงมีค่า
 หลายค่า ดังนั้นในการเลือกว่าควรใช้ขั้นใดในการกำหนดอัตราเร็วของปฏิกิริยา
ควรเลือกขั้นที่มีค่า หลายค่า ดังนั้นในการเลือกว่าควรใช้ขั้นใดในการกำหนดอัตราเร็วของปฏิกิริยา
ควรเลือกขั้นที่มีค่า  มากที่สุด นั่นคือ ขั้นที่เกิดช้าที่สุดเป็นขั้นตอนในการเกิดปฏิกิริยา
เรียกว่า Rate Determining
Step ดังนั้น พลังงานก่อกัมมันต์ของปฏิกิริยานี้
หาได้จาก มากที่สุด นั่นคือ ขั้นที่เกิดช้าที่สุดเป็นขั้นตอนในการเกิดปฏิกิริยา
เรียกว่า Rate Determining
Step ดังนั้น พลังงานก่อกัมมันต์ของปฏิกิริยานี้
หาได้จาก  และพลังงานแต่ละปฏิกิริยาย่อย เป็นดังนี้ และพลังงานแต่ละปฏิกิริยาย่อย เป็นดังนี้
ขั้นตอนที่
1 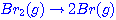 เป็นปฏิกิริยาแบบดูดพลังงาน เป็นปฏิกิริยาแบบดูดพลังงาน
ขั้นตอนที่
2  เป็นปฏิกิริยาแบบคายพลังงาน เป็นปฏิกิริยาแบบคายพลังงาน
ขั้นตอนที่
3  เป็นปฏิกิริยาแบบคายพลังงาน เป็นปฏิกิริยาแบบคายพลังงาน


|

