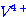![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
|
คำชี้แจง ให้นักเรียนเลือกคำตอบที่ถูกต้องที่สุดเพียงข้อเดียว เรื่อง อัตราการเกิดปฏิกิริยาเคมี จำนวน 10 ข้อ 1. ข้อใดต่อไปนี้ เป็นข้อความที่ไม่ถูกต้อง 2. ปฏิกิริยา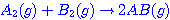 มีพลังงานก่อกัมมันต์ไปข้างหน้า 140.5 kJ และมีพลังงานก่อกัมมันต์ย้อนกลับ
85.0 kJ ข้อความใดถูกต้อง มีพลังงานก่อกัมมันต์ไปข้างหน้า 140.5 kJ และมีพลังงานก่อกัมมันต์ย้อนกลับ
85.0 kJ ข้อความใดถูกต้อง
ข. ปฏิกิริยานี้ดูดพลังงานมากกว่า 55.5 kJ ค. สารที่เป็นสารผลิตภัณฑ์มีพลังงานสูงหว่าสารที่เป็นสารตั้งต้น ง. ปฏิกิริยานี ผันกลับไม่ได้ ์
ก. จำนวนอนุภาคของสารตั้งต้นเพิ่มมากขึ้น
เป็นการลดพลังงานกระตุ้น  ไปเป็น ไปเป็น 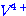 มี 2 ขั้นตอน ดังนี้ มี 2 ขั้นตอน ดังนี้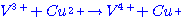 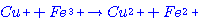 ตัวเร่งของปฏิกิริยาคือตัวใด
ก. 1. ทำให้อนุภาคของสารตั้งต้นชนกันบ่อยครั้งขึ้น 2. ทำให้พลังงานก่อกัมมันต์ของสารตั้งต้นลดลง 3. ทำให้อนุภาคที่มีพลังงานสูงเพิ่มขึ้น
ก. 1
เท่านั้น 1. ตัวหน่วงปฏิกิริยาทำให้พลังงานก่อกัมมันต์ของปฏิกิริยานั้นสูงขึ้น 2. ไม่ว่าจะเติมตัวหน่วงปฏิกิริยาหรือไม่ ผลิตภัณฑ์ของระบบก็ยังคงเดิม คุณภาพและปริมาณเท่าเดิม 3. ขณะที่เกิดปฏิกิริยาตัวหน่วงปฏิกิริยาจะเข้าทำปฏิกิริยากับสารตั้งต้นด้วย โดยเปลี่ยนไปเป็นโมเลกุลชั่วคราว ข้อความใดถูกต้อง
ก. 1
และ 2 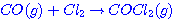 อยากทราบว่าถ้าเพิ่มความดันของก๊าช อยากทราบว่าถ้าเพิ่มความดันของก๊าช 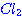 เป็น 2 เท่า เป็น 2 เท่า1. ความเข้มข้นของ 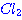 เพิ่มขึ้นเป็น 2 เท่า เพิ่มขึ้นเป็น 2 เท่า 2. อัตราการเกิดสารผลิตภัณฑ์จะเพิ่มขึ้น 3. อัตราการลดลงของ CO จะลดลง 4. ปริมาณสารผลิตภัณฑ์จะเพิ่มขึ้น ข้อใดต่อไปนี้ ถูกต้อง
ก. 1
,2 และ 3  เมื่อทำการเปลี่ยนแปลงข้อใดต่อไปนี้ ไม่ทำให้อัตราการเกิดปฏิกิริยาเพิ่มขึ้น เมื่อทำการเปลี่ยนแปลงข้อใดต่อไปนี้ ไม่ทำให้อัตราการเกิดปฏิกิริยาเพิ่มขึ้น
ก. เพิ่มปริมาตรสารตั้งต้น
ก.
พลังงานของปฏิกิริยา  เท่ากับ 200 เท่ากับ 200  และพลังงานก่อกัมมันต์ของ ปฏิกิริยา และพลังงานก่อกัมมันต์ของ ปฏิกิริยา เท่ากับ 260 เท่ากับ 260  ข้อใดถูกต้อง ข้อใดถูกต้อง
ก.
ปฏิกิริยาดูดพลังงาน 60 |